ЕС проверит испытания «Спутника V» на соблюдение этических норм
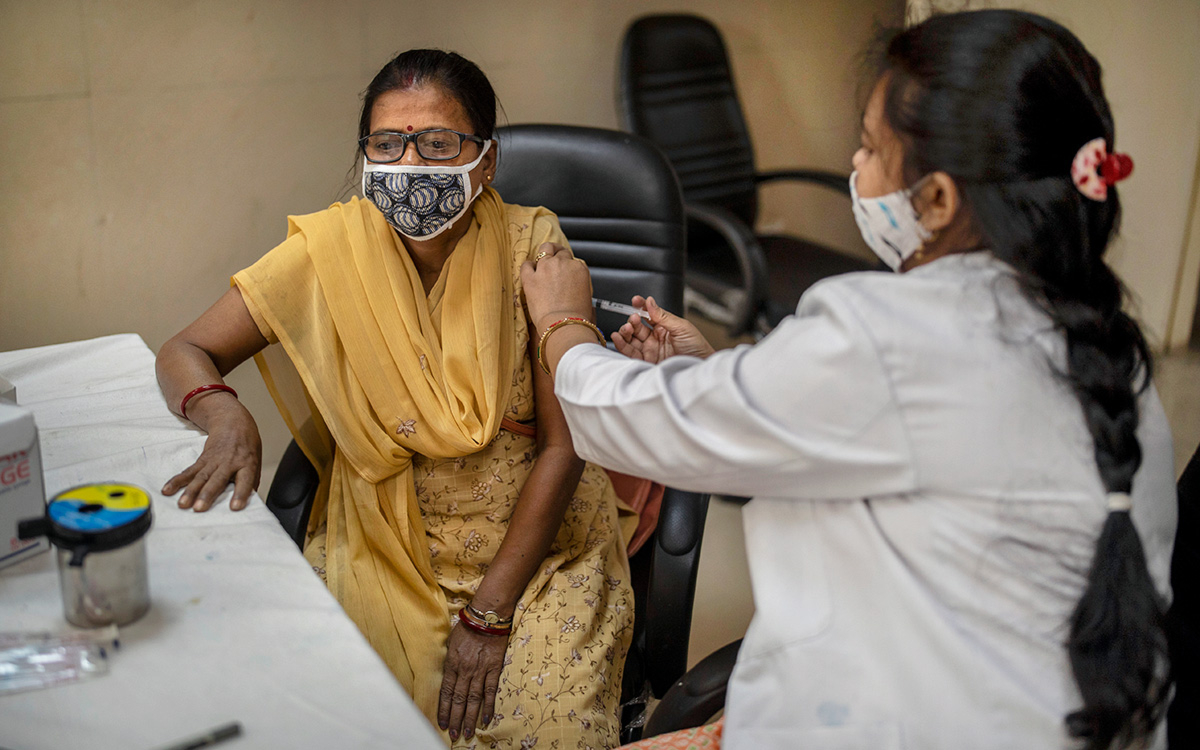
На следующей неделе регуляторный орган Евросоюза начнет расследование того, соответствуют ли клинические испытания российской вакцины «Спутник V» от коронавируса мировым этическим и научным стандартам, сообщает The Financial Times.
Европейское агентство по лекарственным средствам расследует вопрос, были ли исследования проведены с соблюдением этических норм, сообщили собеседники FT.
Так, в исследованиях вакцины участвовали военные и государственные служащие. В декабре Reuters сообщил, что корреспонденты агентства поговорили с 32 участниками испытаний российской вакцины, девять из которых заявили, что «они не настоящие добровольцы». При этом никто не сказал, что им вводили инъекции против их воли, отмечало агентство.
Кирилл Дмитриев, глава Российского фонда прямых инвестиций (РФПИ), сказал газете, что никакого давления на участников не было и при испытаниях соблюдались все клинические практики. По словам Дмитриева, проверка EMA должна начаться на следующей неделе.
Отдельная инспекция EMA производственных объектов в России, которая была запланирована на следующий месяц, была отложена на несколько дней из-за визитов инспекторов из стран, которые разместили заказы на вакцину, сказал Дмитриев. «Мы отдаем приоритет для проверок тем странам, которые взяли на себя обязательство покупать вакцины... в отличие от Европейской комиссии», — пояснил Дмитриев.
В конце марта глава департамента угроз здоровью и стратегии вакцинации ЕМА Марко Кавалери заявил, что агентство направит в апреле в Россию группу экспертов для проверок клинических испытаний и производства российской вакцины от коронавируса «Спутник V». После проверки производства и получения всей информации о технологиях речь может идти об одобрении вакцины для применения в странах Евросоюза, указывал он.
Европейский союз столкнулся с критикой своей программы вакцинации против коронавируса, указывает FT. Блок вакцинировал значительно меньше людей, чем Великобритания или США в процентном отношении к населению, причем официальные лица называли отсутствие вакцин как одну из причин.
Страны — члены ЕС Венгрия и Словакия закупили российские вакцины в соответствии с правилами чрезвычайной ситуации. При этом словацкий премьер-министр Игорь Матович был вынужден уйти в отставку после того, как его решение купить российскую прививку вызвало негативную реакцию со стороны членов правящей коалиции.
22 марта еврокомиссар по вопросам внутреннего рынка Тьерри Бретон заявил, что ЕС не нуждается в российской вакцине, поскольку Европе достаточно четырех других, которые уже зарегистрированы. Бретон отметил, что Евросоюз готов помочь России с производством вакцины. Президент Владимир Путин назвал эти высказывания странными, указав, что Россия никому ничего не навязывает. По мнению директора Центра эпидемиологии и микробиологии им. Н.Ф. Гамалеи Александра Гинцбурга, Евросоюз не спешит допускать на свой рынок российскую вакцину, опасаясь, что она сможет составить серьезную конкуренцию препаратам, продвигаемым в Европе.
Этические стандарты проведения медицинских экспериментов с участием людей сформулированы в Хельсинкской декларации Всемирной медицинской ассоциации, принятой в 1964 году и уточнявшейся на конгрессах Ассоциации в Токио (1975), Венеции (1983) и Гонконге (1989).
Универсальным требованием, предъявляемым к проведению экспериментов и клинических испытаний на людях, является предварительное тщательное лабораторное исследование, в том числе на животных. Декларация предписывает, чтобы проекты исследований на человеке проходили независимую от экспериментаторов и финансирующих организаций этическую экспертизу с целью предотвратить нарушение прав человека и гражданина. При этом должен тщательно соблюдаться принцип добровольного информированного согласия на участие в роли объекта экспериментов. Человек должен получить адекватную информацию о целях и методах эксперимента, а также о риске возможных неблагоприятных последствий. Его обязаны информировать о безусловном праве отказа от участия в экспериментах и праве выйти из него на любой стадии. Испытания и эксперименты на здоровых людях должны проходить исключительно на добровольцах.
«При получении информированного согласия на участие в исследовании врач должен быть особенно осторожен в тех случаях, когда потенциальный субъект находится в зависимом положении по отношению к исследователю, или когда существует риск получения согласия под принуждением», — гласит текст декларации.
Протокол предстоящего исследования до его начала должна рассмотреть комиссия по вопросам этики, которая должна быть независима от исследователя, спонсора или любого иного влияния.