Настоящее будущее: редактор для генов CRISPR

Статья написана в рамках спецпроекта «Настоящее будущее» журнала РБК
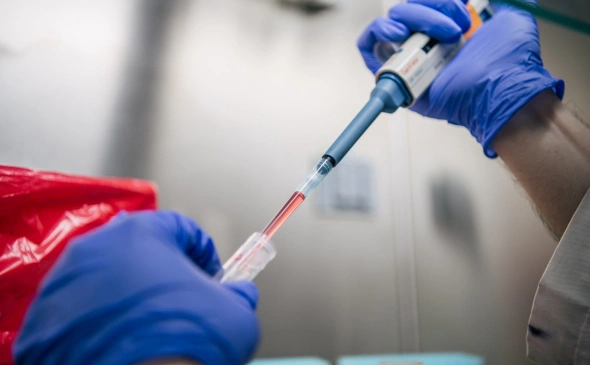
Технологии CRISPR/Cas9 всего несколько лет — массовое осознание ее возможностей в научной среде пришло к 2013 году, но возможности эти завораживают. После того как трое ученых, больше других сделавших для изучения новой технологии, лицензировали свои открытия разным стартапам, те получили уже свыше $300 млн инвестиций. Деньги давали Билл Гейтс, Google Ventures и еще несколько видных венчурных фондов. Стартапам еще предстоит создать свои первые продукты, решить неизбежные патентные споры и договориться с регуляторами, но сомнений в большом будущем революционной технологии ни у кого нет.
CRISPR — примерно такой же гигантский шаг вперед по сравнению с традиционной генетической инженерией, как генетическая инженерия по сравнению с естественным отбором. Лечение генетических заболеваний, создание принципиально новых ГМО-существ для пищевых или медицинских целей, модификация переносчиков болезней с целью их нейтрализации — вот только несколько возможных направлений развития для технологии. Человечеству она стала известна позже, чем Facebook, хотя существует миллиарды лет.
О пользе йогуртов
Научную статью, которая меньше чем за десять лет поменяла всю генную инженерию, отправили в журнал Science не ученые из топового университета, а сотрудники компании Danisco, производителя йогуртов «Данон» (в 2011 году куплена DuPont за $6,3 млрд). Их соавторами выступила группа исследователей со стоматологического факультета одного из университетов в канадском Квебеке, которая и вовсе специализировалась на «экологии полости рта». Дело было в 2007 году.
Авторов во главе с Родольфе Барангу волновало здоровье полезных бактерий Streptococcus thermophilus из йогуртовой закваски. Бактерии тоже болеют: типичная для них инфекция — бактериофаг, вирусная частица, которая проникает внутрь клетки и убивает ее. Барангу с коллегами заметили, что сопротивляемость вирусам связана со странной последовательностью бактериального генома под названием CRISPR (по-русски эту аббревиатуру можно расшифровать примерно так: короткие палиндромные повторы, расположенные регулярными группами).
Группа из Danisco поняла, как устроен механизм, позволяющий бактерии защищаться. Бактерия встраивает фрагменты вирусной ДНК к себе в геном (ячейки для хранения фрагментов — это и есть CRISPR), чтобы в следующий раз — возможно, много поколений спустя — опознать бактериофага и перерезать его ДНК строго в точке, соответствующей сохраненному фрагменту. Роль молекулярных ножниц в этом процессе выполняет белок Cas, фермент эндонуклеаза.
Исследователи поняли, что этот метод можно применять и для «обучения» бактерий, предъявляя им новые вирусные частицы. Но это был «низкотехнологический» метод — всю трудную работу по изучению вирусов брали на себя бактерии. И все чаще биологи, поглядев на ювелирную работу по вырезанию ДНК, задумывались: нельзя ли самим научиться применять эти высокоточные ножницы для редактирования геномов?
В августе 2012 года Дженнифер Дудна из университета Калифорнии в Беркли и Эммануэль Шарпентье из шведского университета Умео придумали, как из природного явления соорудить умный станок по переделке ДНК — систему CRISPR/Cas9. Фактически у исследователей появился высокоточный способ менять геномы при помощи инструкций, записанных программным образом на специальные молекулы РНК, как на перфокарты. Теперь чуть ли не каждый год Дудне и Шарпентье прочат за это Нобелевскую премию, а в ноябре 2014-го обе получили Breakthrough Prize (премия в размере $3 млн, учрежденная инвестором Юрием Мильнером, а также создателями Google, Facebook и нескольких других интернет-компаний).
До появления CRISPR/Cas9 генные инженеры работали принципиально менее аккуратно. Например, кроликам встраивали ген медузы, который кодирует флуоресцентный белок GFP (в результате кролики приобретали свойство светиться в темноте), а рису — ген для выработки витамина А. Но для этого годились и грубые методы. «Старые методы использовали случайные вставки абы куда», — объясняет Константин Северинов, профессор Университета Ратгерса (США) и Сколковского института науки и технологий (Россия).
Недавно никто и подумать не мог встроить желаемую последовательность ДНК в нужное место. «Это делалось с помощью рекомбинации, когда ген или его участок вносятся в клетку. Вносятся, как правило, при помощи вируса — а потом этот вирус встраивается в различные места генома, и вы не можете контролировать, ни куда он встраивается, ни в каком количестве. Процедура неконтролируемая и очень неэффективная», — объясняет Северинов.
CRISPR не только точнее, но и проще в использовании — настолько, что в отличие от прежних методов модификации ДНК он доступен энтузиастам-биохакерам, работающим в гараже. «Это очень просто. Вы идете в магазин, покупаете плазмиду, которая кодирует Cas-белок. Заказываете — тривиальнейшим образом — РНК, которая будет узнавать нужное место в ДНК. Потом вводите этот белок или плазмиду, его кодирующую, вместе с РНК в клетку — а дальше все, процесс идет сам собой», — говорит Северинов.
О вреде комаров
В августе 2015 года Билл Гейтс и еще 13 инвесторов заявили о намерении вложить $120 млн в компанию Editas Medicine, которая хочет использовать CRISPR как инструмент генной терапии: редактировать ДНК не в пробирке, а в тканях живых людей. «Можно решать задачи, связанные с лечением простых моногенных заболеваний», — уточняет Северинов.
Довольно часто причина болезни, превращающей человека в тяжелого инвалида, — одна-единственная опечатка в ДНК, мутация, которую можно было бы устранить как раз точечным редактированием генома. Первое, на чем Editas Medicine собирается опробовать новый метод, — это амавроз Лебера 10-го типа, наследственная болезнь, которая приводит к слепоте. Она поражает только клетки сетчатки глаза, и отредактировать ДНК только в них должно оказаться посильной задачей. Еще CRISPR неожиданно открывает перспективу (пока теоретическую) избавить человечество от малярии, хотя это, разумеется, никакая не наследственная болезнь: ее вызывают паразиты. Гены в этом случае полезно подправить не у людей, а у малярийных комаров.
Малярия — тот парадоксальный случай, когда лекарства давно изобретены (за артемизинин в этом году даже присудили Нобелевскую премию китайской исследовательнице Юю Ту), но болезнь победить не удается. Каждый год от малярии умирают 670 тыс. человек, большинство из них дети до пяти лет. Проблема не в препаратах: в Тропической Африке и Юго-Восточной Азии не хватает коек, капельниц, больниц, честных чиновников и политической воли, чтобы решить проблему. Поэтому проще бороться с причиной болезни, чем с ней самой.
Ученых давно занимает идея истребить малярийных комаров при помощи «подсадных уток» — специально разработанных генно-модифицированных особей. В идеале они должны быть носителями гена, который отлично распространится, а потом внезапно убьет всю популяцию. Один из вариантов — отложенное бесплодие: самцы отлично размножаются, а вот их потомки страдают половым бессилием. Другое решение — ген, который способствует рождению только самцов, но не самок: в обоих случаях популяция будет абсолютно здорова, но обречена на смерть из-за невозможности размножаться. Ученые перебирают варианты довольно давно и несколько раз даже выпускали пробные партии модифицированных комаров в дикую природу (в Бразилии и Малайзии) без головокружительных успехов.
Сам замысел не без противоречий: эволюция так работает, что признаки, которые уменьшают выживаемость, в долгосрочной перспективе распространяются плохо. Например, бесплодие трудно передать по наследству. И главное, какой бы оригинальный признак вы ни запрограммировали в генах, его вместе с конкретной хромосомой унаследуют только 50% детей (потомку достается по хромосоме от каждого из родителей), 25% внуков и т.д. — словом, ген просто растворится в популяции.
CRISPR позволяет действовать радикально иначе: редактирование ДНК необязательно заканчивается в лаборатории перед тем, как комара выпускают в дикую среду. Вместо готового продукта в ДНК встраивают печатный станок — активную систему CRISPR/Cas9. Идею сумел реализовать Энтони Джеймс из университета Калифорнии в Ирвине. Если комариным детям досталась только одна модифицированная хромосома, она сама запускает CRISPR/Cas9 и быстро редактирует вторую. В результате признак наследуют не 50, а уже 99,5% потомства. Добавленный ген в этом эксперименте заставляет комара вырабатывать антитела, которые не дают плазмодию развиваться. Комар остается живым, но безвредным — и передает свои гены дальше по цепочке, обезвреживая все большую и большую долю популяции с каждым поколением.
Страхи людей
Мысль, что человек в очереди на пересадку органов ждет трагической смерти какого-нибудь другого человека, который в эту минуту и знать не знает, что станет донором, многим доставляет дискомфорт. Кроме того, доноров всегда меньше, чем претендентов на их сердца и почки. Поэтому медиков давным-давно интересует возможность пересаживать людям не человеческие почки и сердца.
Самые удобные претенденты — свиньи, чья анатомия похожа на нашу. От этой идеи пришлось отказаться в 1990-е, когда стало понятно, что в ДНК у свиней намертво вшит эндогенный ретровирус PERV, который часто заражает людей и делает безопасную пересадку невозможной.
Юридическая защита ГМО
Иррациональные страхи перед ГМО («от томатов с генами медузы у меня прорастут щупальца») приводят к реальным законодательным запретам. CRISPR/Cas9 открывает изящную возможность эти запреты обойти. Большая часть законов описывает ГМО как растения с «добавленными генами». В 2014 году южнокорейский биохимик Джин Су Ким придумал решение. В журнале Nature Biotechnology вышла статья с описанием эксперимента, где Cas9 с РНК-гидом синтезировали в пробирке, а в клетку переносили готовый очищенный белок-эндонуклеазу. Таким способом удалось отредактировать, не оставляя следов в виде «добавленных генов», геномы арабидопсиса, табака, риса и салата-латука. Технически они не могут считаться ГМО.
С появлением CRISPR врачи снова задумываются о пересадке органов свиней людям: гарвардская команда под руководством Джорджа Черча, который 15 лет назад был одним из пионеров проекта «Геном человека», сумела вырезать из свиного генома все 62 копии PERV, которые там нашлись. Это делает свиней почти пригодными донорами.
А как насчет улучшения людей? Эту идею немедленно начинают обсуждать в соцсетях после любого большого прорыва в биотехнологиях. Сами ученые относятся к ней прохладней. В апреле были опубликованы результаты первого и пока единственного опыта по редактированию при помощи CRISPR человеческих зародышей, который провели в китайском Гуанчжоу.
Статью отказались печатать главные научные журналы мира, Nature и Science (которым по новизне и значимости она была вполне соразмерна). Редакторы посчитали работу спорной с этической точки зрения, несмотря на то что оплодотворенные яйцеклетки, которые взяли для опыта, были с самого начала нежизнеспособны, а редактирование ДНК преследовало вроде бы благородную цель — устранение мутации, вызывающей тяжелую наследственную болезнь бета-талассемию.
Буквально за две недели до выхода китайской статьи группа биологов во главе с изобретательницей метода Дженнифер Дудна потребовала ввести всемирный мораторий на редактирование человеческой ДНК при помощи CRISPR (лечения сетчатки это не касается — речь идет только об изменениях, которые могут быть унаследованы). Метод, считают авторы петиции, открывает настолько соблазнительные перспективы, что его могут начать применять на практике раньше, чем убедятся в его безопасности. Например, потому, что китайский эксперимент закончился явным успехом только для 14,3% эмбрионов. Для опыта с мини-пигами или комарами — отличный результат: нам ничего не стоит взять только удачные экземпляры и забраковать неудачные. А вот для опыта с живыми людьми — пожалуй, вряд ли.